Moncef Slaoui, que es el asesor principal del programa estadounidense para el desarrollo de tratamientos y vacunas para el coronavirus, declaró a la prensa:
“Al examinar los datos, los pacientes o sujetos con antecedentes de reacciones alérgicas graves han sido excluidos del ensayo clínico”.
“Asumo –porque la Administración de Alimentos y Medicamentos de Estados Unidos FDA tomará esas decisiones– que esto será parte de lo que se tome en cuenta, y como en el Reino Unido, la expectativa sería que a los sujetos con reacciones severas conocidas, (se les pedirá) que no tomen la vacuna hasta que entendamos exactamente lo que sucedió aquí”, indicó el experto, citado por la agencia AFP.
Reacciones por la vacuna incluyen parálisis facial temporal
La noticia sigue a una advertencia similar en Reino Unido después de que dos trabajadores de la salud sufrieran reacciones alérgicas y necesitaran tratamiento.
Tanto Reino Unido como Canadá ya aprobaron el régimen de vacunas de dos dosis en modalidad de emergencia y se espera que Estados Unidos haga lo mismo en cuestión de días, después de que un panel asesor de la FDA se reúna este jueves sobre el tema.
La FDA probablemente también les pedirá a los proveedores de las vacunas que estén atentos para determinar si las personas desarrollan una forma rara pero temporal y no muy grave de parálisis facial llamada parálisis de Bell, después de que los datos mostraran que cuatro de las aproximadamente 19.000 personas en el ensayo sufrieran la enfermedad.
En general, Slaoui dijo que estaba impresionado por los datos de la vacuna que habían surgido en los documentos informativos presentados a la FDA, incluido sobre todo que se desarrolló una fuerte protección después de la primera dosis, aunque la recomendación sigue siendo tomar ambas inyecciones, con 21 días de diferencia.
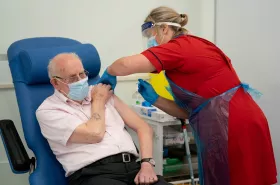

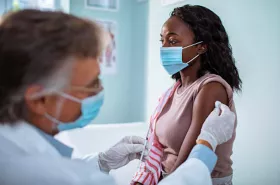
No se sabe exactamente cuándo la agencia reguladora estadounidense podría emitir su autorización de uso de emergencia, pero el secretario de salud Alex Azar indicó que los funcionarios tienen en mente que sea a partir del sábado 12 de diciembre.
Estados Unidos espera vacunar a 20 millones de personas este mes y los residentes de centros de cuidados a largo plazo y trabajadores de la salud son la prioridad. (Según información reciente, la vacuna podría empezar a aplicarse a partir de la semana comprendida entre el 14 y el 21 de diciembre)
En días pasados, se supo que el presidente de Estados Unidos, Donald Trump, se negó a comprar más dosis de la vacuna (en junio pasado) pensando que el fin de la pandemia estaba “a la vuelta de la esquina” y ahora podría necesitar más dosis, pero la farmacéutica Pfizer que las produce ya tiene vendida su producción a otros países.
El siguiente video registra el hecho de que la FDA reconoce que la vacuna de Pfizer cumple con los requisitos técnicos, antes de la reunión de este jueves 10 de diciembre, cuando se tomarán decisiones:
Estados Unidos capturó a Nicolás Maduro y a su esposa
El presidente Donald Trump confirmó que fue el dictador fue capturado y extraído desde Venezuela en la madrugada de este 3 de enero.
LO ÚLTIMO


.svg)