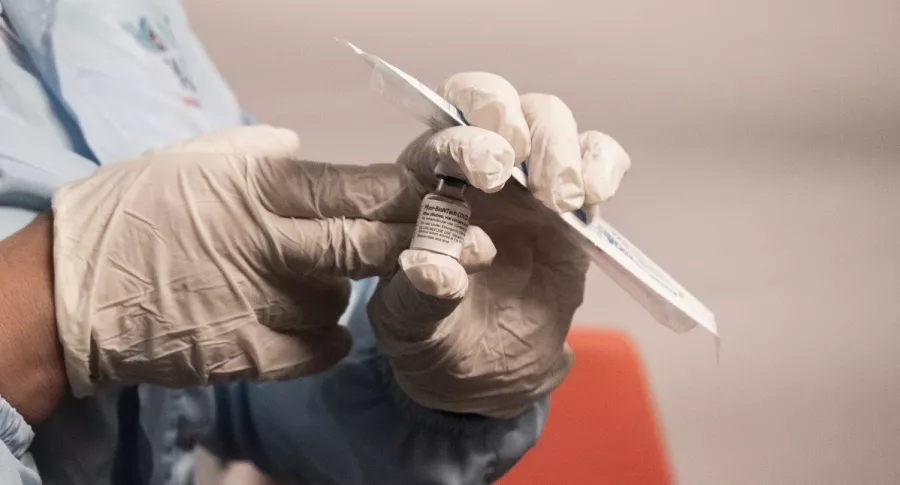
Desde la farmacéutica le solicitaron al Invima que modificara dicha autorización sanitaria y la autoridad aprobó que se actualice “el grupo etario que podrá recibir las dosis de este biológico”.
En un comunicado, la entidad señaló que evaluó la documentación y determinó dar su aval para incluir a personas de 12 años y mayores, “encontrando un balance riesgo-beneficio favorable”.
Según eso, la autorización a Pfizer incluye “dos dosis (0,3 mL cada una) administradas intramuscularmente y separadas entre sí por 21 días”.
(Lea también: Mayor capacidad de contagio y más de la variante Delta, que tiene en alerta al Minsalud)




Además, explicó que la Autorización Sanitaria de Uso de Emergencia (ASUE) “está condicionada a los nuevos conocimientos que surjan en relación con la seguridad y eficacia de la vacuna, derivados de los estudios clínicos en curso y de la experiencia clínica que se va acumulando de su uso en la cotidianidad”.
Es decir que los expertos continuarán monitorizando los efectos del biológico en niños y adolescentes para determinar si se mantiene o si podría revocarse la autorización.
En ese sentido, el Invima recomendó seguir con los estudios de efectividad, seguridad y uso en el contexto colombiano, por lo que “establece la realización de estos en la población objeto de la solicitud de modificación, incluyendo la vigilancia activa de reacciones inmunomediadas“.
Por último, recomendó a las demás farmacéuticas que si desean obtener la misma autorización deben presentar todos los soportes en materia de seguridad y eficacia frente al COVID-19 que las respalden.
LO ÚLTIMO


.svg)