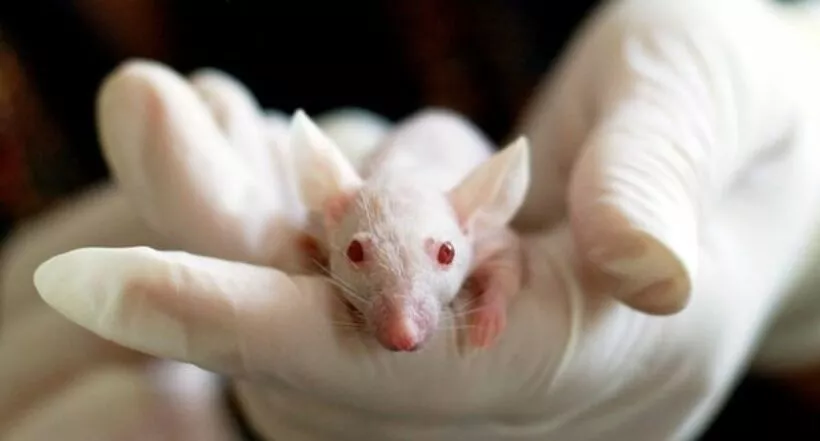
Los nuevos medicamentos para humanos ya no tendrán que ser probados en animales para recibir la aprobación de la Administración de Alimentos y Medicamentos de EE.UU. (FDA, por sus siglas en inglés). Esto no significa que ya no se experimentará con especies de fauna, sino que la entidad podrá autorizar un fármaco sin esa exigencia.
(Vea también: Conozca las recomendaciones y contraindicaciones del lomotil)
Con el cambio de normativa, que regía desde 1938, el Congreso parece haber respondido a la aparición de nuevos métodos de ensayo clínico y al creciente sentimiento público en contra de la investigación con animales. Fueron los senadores Rand Paul (republicano de Kentucky) y Cory Booker (demócrata de Nueva Jersey) quienes introdujeron los cambios, aprobados por unanimidad en septiembre de 2022.
En diciembre, el presidente Joe Biden lo convirtió en ley como parte de las Asignaciones Consolidadas, que financia al gobierno durante este año fiscal. Organizaciones como Center for a Human Economy y Animal Wellness Action fueron claves en este avance y sostienen que la FDA debería basarse en modelos informáticos como los “chips de órganos” y otros métodos sin animales que se han desarrollado.




A pesar de esto, otros sectores restan importancia a la ley y afirman que el proceso de aprobación de medicamentos no va a cambiar de la noche a la mañana. Jim Newman, director de comunicaciones de Americans for Medical Progress, dice que las tecnologías sin animales están aún “en pañales” y no podrán sustituir a los modelos actuales hasta dentro de muchos años. Tampoco cree que exigencias como las pruebas de toxicidad en especies de roedores y no roedores cambien de rumbo en breve.
Cabe recalcar que más de nueve de cada diez fármacos que se someten a ensayos clínicos en humanos fracasan por su inseguridad o ineficacia, lo que da argumentos a quienes sostienen que los experimentos con animales son una pérdida de tiempo, dinero y vidas. “Los modelos animales se equivocan más a menudo de lo que aciertan”, afirma Don Ingber, bioingeniero de la Universidad de Harvard cuyo laboratorio desarrolló una tecnología de chips de órganos que ahora comercializa la empresa Emulate.
Estos chips suelen consistir en canales incrustados en polímeros a base de silicona que están recubiertos de células y tejidos vivos de órganos como el cerebro, el hígado, los pulmones y los riñones. Así, líquidos corren a través de ellos simulando el flujo sanguíneo que circula por los pequeños vasos, como ocurre en los órganos vivos. Por ejemplo, un chip de hígado humano puede dar una alerta de toxicidad cuando un fármaco experimental daña las células.
Entretanto, Namandjé Bumpus, científico de la FDA, menciona que desde la entidad apoyarán los métodos alternativos que estén respaldados por la ciencia y que demuestren su seguridad y eficacia.“Seguimos animando a los desarrolladores que trabajan en métodos alternativos a que presenten sus trabajos”, precisa. Además, señala que la agencia solicitó y recibió 5 millones de dólares este año para poner en marcha un programa en toda la FDA con miras a desarrollar métodos que sustituyan, reduzcan y perfeccionen los ensayos con animales.
LO ÚLTIMO

.svg)